✳️ 导语
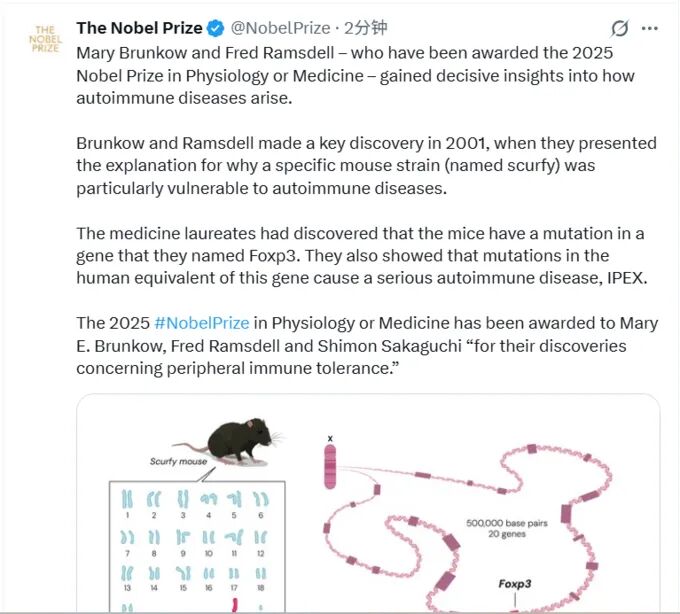
2025年10月6日,诺贝尔生理学或医学奖授予了三位科学家——
Mary E. Brunkow、Fred Ramsdell 和 Shimon Sakaguchi,
以表彰他们对外周免疫耐受(peripheral immune tolerance)机制的开创性发现。
这一突破揭示了人体免疫系统的“自我克制”机制,阐明了调节性T细胞(Treg)和关键基因 Foxp3 在维持免疫平衡中的核心作用。
它不仅革新了我们对自身免疫病、器官移植排斥与肿瘤免疫调节的理解,更为未来的精准免疫治疗奠定了基石。

🧩 一、免疫系统的“双刃剑”
免疫系统是一把锋利的剑。
它能识别“外来者”并清除感染,却也可能误伤“自己”。
为避免自我攻击,人体建立了两层防线:
-
中央耐受(central tolerance):在胸腺或骨髓阶段清除高自反应性淋巴细胞;
-
外周耐受(peripheral tolerance):对已进入体内外周组织的成熟免疫细胞进行再调控。
长期以来,科学界一直在追问——
当“中央筛查”失效时,免疫系统如何在外周防止自体攻击?
2025年的诺贝尔奖,正是对这一谜题的系统性回答。

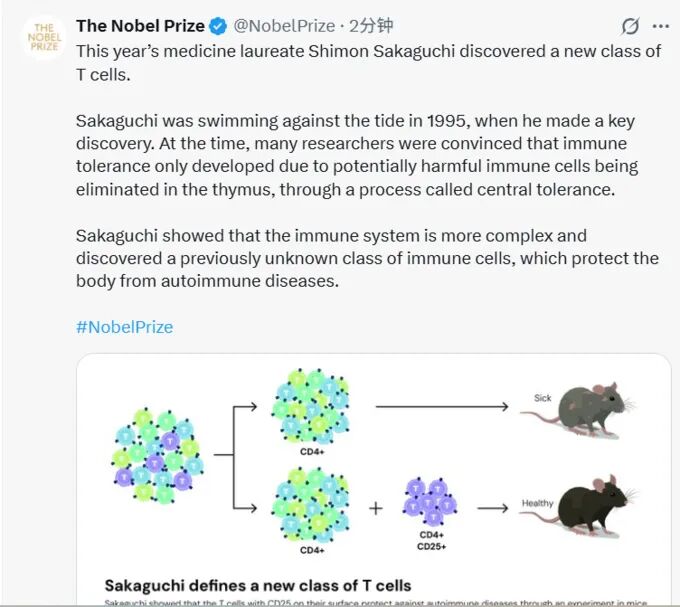
🧬 二、获奖者与核心发现
|
获奖者
|
国家
|
主要贡献
|
|---|---|---|
|
Shimon Sakaguchi
|
日本
|
首次提出并验证调节性T细胞的存在
|
|
Mary E. Brunkow
|
美国
|
发现Foxp3基因的突变可导致致命性免疫失调
|
|
Fred Ramsdell
|
美国
|
揭示Foxp3在Treg发育与功能中的主控作用
|
他们的研究揭示:
调节性T细胞(Treg)是免疫系统的“刹车”,Foxp3是掌控这辆车的方向盘。

🔬 三、机制阐释:免疫“自我宽容”的密码
1️⃣ 调节性T细胞(Treg)的角色
Treg 是一类特殊的CD4⁺ T细胞,具有强大的免疫抑制功能。
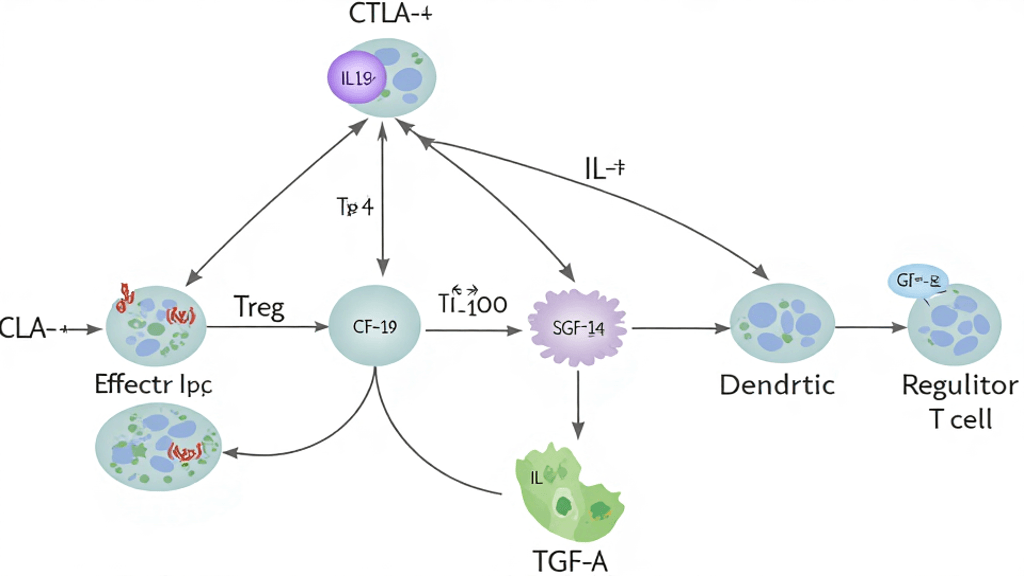
它们通过以下方式维持体内免疫稳态:
-
抑制效应T细胞(Teff)的过度活化;
-
降低抗原呈递细胞(APC)的刺激信号;
-
分泌免疫抑制性细胞因子(如 IL-10、TGF-β);
-
调控局部代谢环境,减少炎症反应。
一句话:
Treg 是免疫系统的“制动器”,防止免疫暴走。
2️⃣ Foxp3:调控的“主控开关”
Foxp3 是Treg细胞发育与功能的核心转录因子。
Brunkow 与 Ramsdell 在小鼠与人类实验中发现:
Foxp3基因突变会导致严重的自身免疫综合征(IPEX)
表现为多器官免疫攻击、肠炎与糖尿病。
这说明:
➡️ Foxp3 决定了 Treg 的身份;
➡️ Foxp3 功能失常意味着免疫系统“刹车失灵”。
3️⃣ 外周免疫耐受的实现机制
外周免疫耐受并非单一机制,而是多重系统协作的结果:
-
CTLA-4通路抑制:Treg 与树突状细胞(DC)结合,削弱共刺激信号;
-
抑制性细胞因子:IL-10、IL-35 等抑制周围免疫反应;
-
IL-2竞争机制:Treg 高表达CD25,消耗IL-2,阻止效应T细胞扩增;
-
代谢调控:通过腺苷等代谢产物营造抑制性微环境。
这张复杂的免疫“刹车系统”,构成了外周免疫耐受的根基。
⚗️ 四、临床应用前景:从理论到疗法
✅ 1. 自身免疫病治疗
通过体外扩增或激活Treg,有望控制糖尿病、红斑狼疮、类风湿关节炎等疾病。
全球多家机构已启动早期临床试验。
✅ 2. 器官与干细胞移植
调节性T细胞疗法有助于降低排斥反应,
可与免疫抑制剂联合,减少药物毒性。
✅ 3. 肿瘤免疫调节
在肿瘤微环境中,Treg 常被“劫持”抑制抗肿瘤免疫。
精准靶向Treg的抑制策略,或将提升癌症免疫治疗的疗效。
✅ 4. 精准与合成免疫工程
借助CRISPR基因编辑或小分子药物,
未来可实现对Foxp3与Treg通路的可控激活与关闭,
开辟“定向免疫调节”的新纪元。

⚠️ 五、面临的挑战
1️⃣ 特异性问题:全身增强Treg可能削弱抗感染或抗癌能力;
2️⃣ 稳定性风险:Treg在炎症环境下可能“叛变”为促炎细胞;
3️⃣ 个体差异:不同疾病与人群的免疫耐受机制存在显著差异。
因此,未来研究将聚焦于——
如何精准、可逆、可控地操纵免疫“刹车”。
🌍 六、科学的延伸意义
2025年的诺贝尔奖不仅是对三位科学家的致敬,
更是对人类理解自身防御系统的里程碑式突破。
这项发现,让我们看到一个更复杂、更智慧的免疫系统:
它不仅能战斗,也懂得宽容。
免疫的“自我克制”,
或许正是生物体进化中最高级的智慧。
📚 参考文献
The Nobel Assembly at Karolinska Institutet. The Nobel Prize in Physiology or Medicine 2025: Popular Information. NobelPrize.org, 2025.
Brunkow M. E. et al. “Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse.” Nature Genetics. 2001.
Ramsdell F. & Brunkow M. E. “Regulatory T cells and Foxp3: key to immune homeostasis.” Annual Review of Immunology.
Sakaguchi S. et al. “Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor α-chains.” Journal of Immunology. 1995.
Chemical & Engineering News (2025). Immunity researchers win the 2025 Nobel Prize in Physiology or Medicine.
Reuters Health (2025). Foxp3 discovery earns 2025 Nobel Prize in
Medicine.